31. Mai 2015 “Regulatory Usability“ und „Market Usability“ verzahnen
Das Thema Usability ist in die Medizinproduktebranche eingezogen. Seitdem klar ist, dass schlechte Usability bei Medizinprodukten zu Risiken und Schädigungen von Patienten führt, sind benannte Stellen wie der TÜV als auch nationale Zulassungsstellen (wie z.B. die U.S. Food and Drug Administration, kurz FDA) sensibel geworden und verlangen Nachweise über einen wirksamen Usability-Engineering-Prozess, der der Entwicklung eines Medizinprodukts (das für den Markt zugelassen werden soll) zugrunde liegen muss. Auch internationale Standards, wie die IEC 62366-1:2015 „Application of usability engineering to medical devices” fordern einen wirksamen Usability-Engineering-Prozess vom Hersteller.
Doch wie damit praktisch umgehen als Hersteller? Wie weit muss man gehen?
Um als Hersteller eines Medizinprodukts hier die richtigen Entscheidungen bei der Anpassung des eigenen Entwicklungsprozesses treffen zu können, ist zunächst wichtig zu verstehen, was Usability wirklich ist.
Die Grundnorm für Usability DIN EN ISO 9241-11 beschreibt Usability als "das Ausmaß, in dem ein Produkt durch bestimmte Nutzer in einem bestimmten Nutzungskontext genutzt werden kann, um bestimmte Ziele effektiv, effizient und zufriedenstellend zu erreichen."
Die zurzeit in der Überarbeitung befindliche DIN EN ISO 9241-11 wird den Begriff „Effektiv“ in ihrer nächsten Ausgabe erweitern um das Attribut „without negative side effects“.
- Der Fokus von „Regulatory Usability“ liegt darauf, bei der Benutzung effektiv Benutzungsfehler zu vermeiden, die zu Gefährdungssituationen und daraus resultierenden Risiken und Schädigungen (d.h. „negative side effects“) für Patienten sowie medizinisches Personal führen.
- Der Fokus von „Market Usability“ liegt darüber hinaus darauf, dass das Produkt bei der Benutzung effizient die Erledigung der jeweiligen Aufgabe unterstützt und zu einer hohen Zufriedenheit und positivem Benutzererlebnis (User Experience) führt.
Abbildung 1 veranschaulicht den Unterschied zwischen „Regulatory Usability“ und „Market Usability“ mit Hilfe der sieben Grundsätze der Dialoggestaltung (aus DIN EN ISO 9241-110).
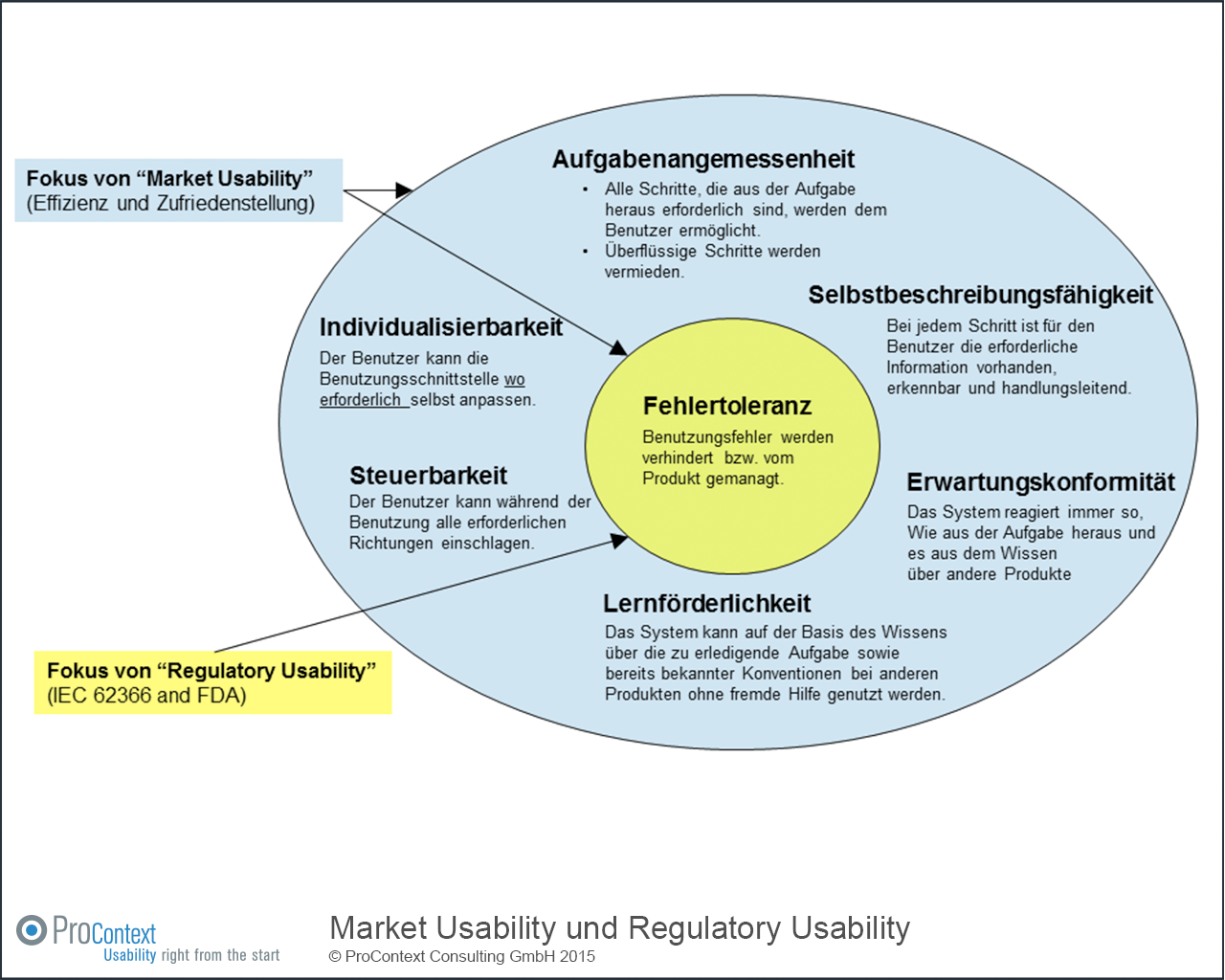 Abbildung 1: Fokus von „Market Usability“ und Fokus von „Regulatory Usability“
Abbildung 1: Fokus von „Market Usability“ und Fokus von „Regulatory Usability“
Die normativen Anforderungen an Entwicklungsprozesse für „Regulatory Usability“ fordern überwiegend Aktivitäten, die auch erforderlich sind, um „Market Usability“ zu erreichen. Abbildung 2 verdeutlicht dies. Das zu tätigende Investment, um „Market Usability“ zu erreichen, ist kaum höher als das erforderliche Investment um „Regulatory Usability“ im Prozess sicherzustellen. Insofern sollte man als Hersteller die Chance nutzen und beide Fliegen mit einer Klappe schlagen.
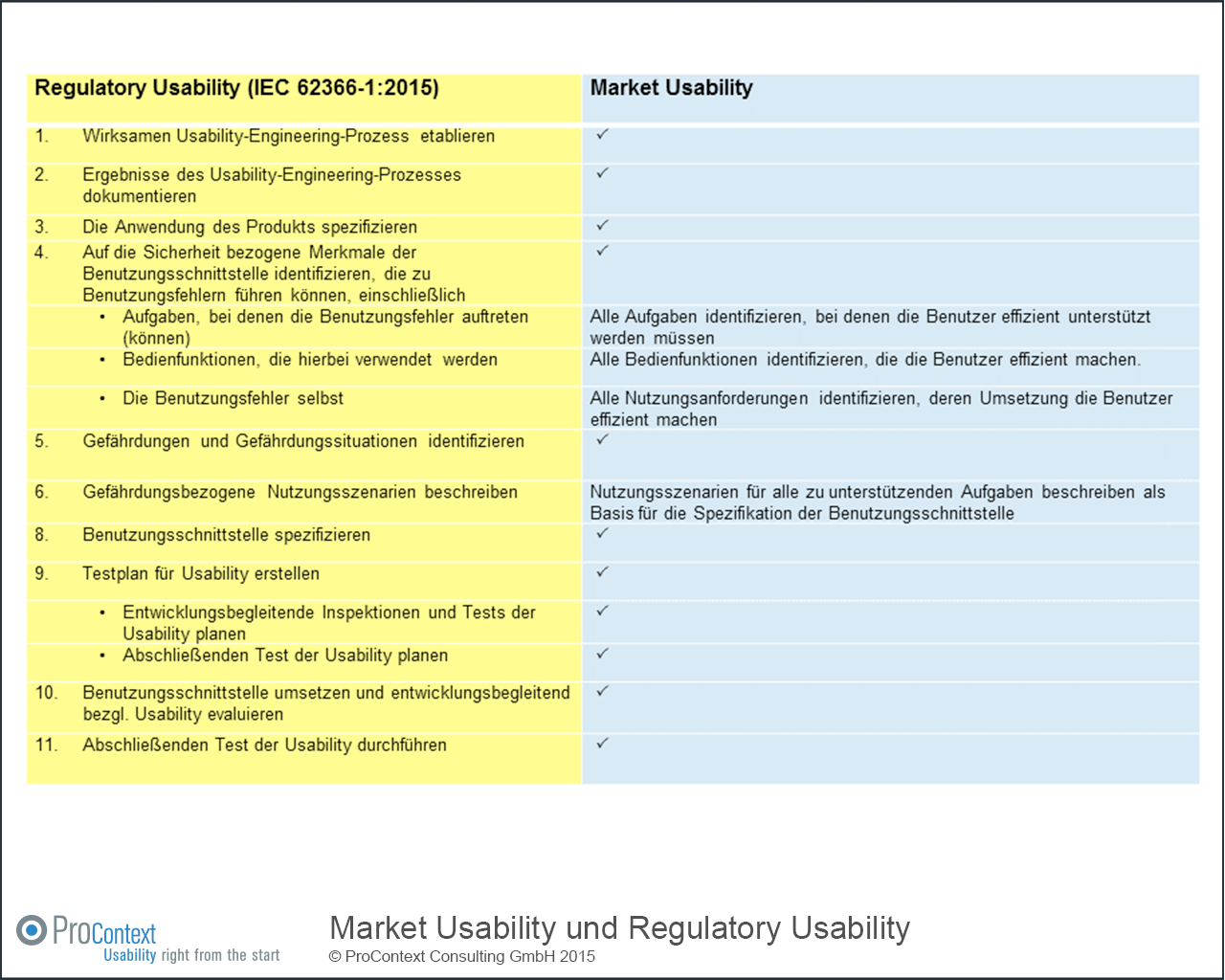 Abbildung 2: Aufwände für „Regulatory Usability“ und Aufwände für „Market Usability“
Abbildung 2: Aufwände für „Regulatory Usability“ und Aufwände für „Market Usability“
Ein wichtiger Faktor für das effiziente Spezifizieren von Produkten ist, dass solche Daten, die über einzelne Entwicklungsprojekte hinweg typisch erhalten bleiben, und immer wieder in Projekten als Arbeitsgrundlage benötigt werden, konsequent für neue Projekte bereitgehalten werden, ohne jedes Mal wieder „bei null“ anfangen zu müssen.
Zu solchen „stabilen Daten“ in der Produktentwicklung gehören insbesondere:
- Benutzergruppenprofile
- Zu unterstützende Aufgaben (Kernaufgaben und Teilaufgaben)
- Erfordernisse und Nutzungsanforderungen bei der Aufgabenerledigung
- Gefährdungen und Gefährdungssituationen
- Bekannte und vorhersehbare Benutzungsfehler
- Erprobte Risikobeherrschungsmaßnahmen
Wie bei den klassischen Systemanforderungen ist auch hier ein professionelles Informationsmanagement nur mit geeigneter Tool-Unterstützung möglich. Der ProContext ProductManager ist eine Software, die beim benutzer-orientierten Spezifizieren von Produkten und dem Managen der zugehörigen Entwicklungsprojekte alle relevanten Daten tagesaktuell bereithält und so konsequent den Fokus der Entwicklung auf den Benutzer des Systems ausrichtet. Dies ist völlig unabhängig davon, ob Sie Medizinprodukte entwickeln oder z.B. betriebswirtschaftliche Software.
Wenn Sie besser verstehen wollen, wie auch Sie Ihre Produkte sicher in der Handhabung machen (Regulatory Usability) als auch effizient und zufriedenstellend für Ihre Benutzer (Market Usability), dann kommen Sie einfach zum Seminar Usability, Requirements und die IEC 62366 in Konstanz. Gerne kommen wir auch direkt zu Ihnen ins Haus. Über 100 namhafte Hersteller und Betreiber von Systemen vertrauen unserer Expertise.
-
Vorheriger Artikel (7.04.2015)
Usability auf mobilen Systemen ist Schwerpunkt bei Kongress ‚Connecting Healthcare IT” 2015
-
Nächster Artikel (11.07.2015)
Buch: Effizient IEC 62366- und FDA-konform dokumentieren